默克Tepmetko在日本获批上市!治疗MET突变NSCLC患者
MET基因,全名间质上皮转化因子,其编码合成的蛋白是肝细胞生长因子(HGF)的受体酪氨酸激酶(RTKs),MET与HGF结合可以激活参与肿瘤发生和转移的RAS-MAPK和PI3K-AKT信号传导途径。
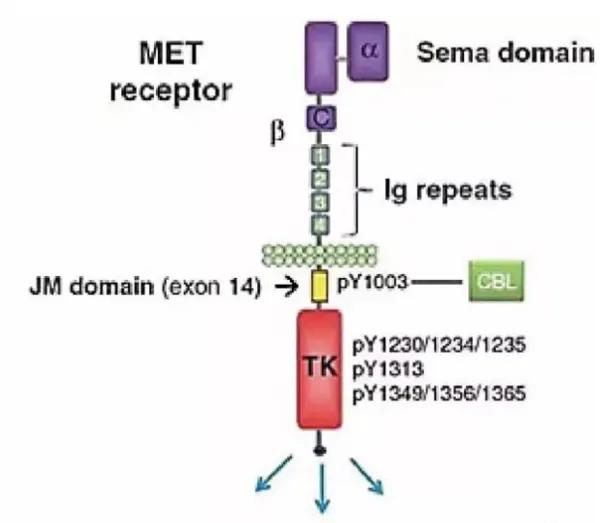
研究显示MER突变激活途径多样,包括因突变、扩增、重排和蛋白过表达等形式,主要集中在MET 14外显子跳跃性突变。
MET基因14外显子跳跃缺失多发生于非小细胞肺癌,并以其中的肺肉瘤样癌和腺癌更多见,在肺腺癌中的发生率约3%~4%,在肺肉瘤样癌中的发生率可高达22%。
另外其他癌症类型如胃癌(7.1%)、结直肠癌(0~9.3%)、脑胶质瘤(0.4%)都发现了MET基因的14号外显子跳跃突变。
2020年3月25日,默克公司(Merck KGaA)宣布日本厚生劳动省批准了Tepmetko (tepotinib)上市,用于治疗不可切除、MET外显子14跳跃突变的晚期或复发性非小细胞肺癌(NSCLC)患者。
tepotinib成为全球第一款获批用于治疗携带MET基因突变的晚期NSCLC患者的口服MET抑制剂。
商品名:Tepmetko
通用名:tepotinib
靶点:MET
厂家:Merck KGaA(默克)
美国首次获批:未获批
中国首次获批:未获批
获批适应症:用于治疗不可切除、MET外显子14跳跃突变的晚期或复发性非小细胞肺癌(NSCLC)患者
规格:250mg/片
推荐剂量:每日500mg,每日一次,口服
临床数据
此次批准是基于一项单臂、II期研究结果(VISION研究)。该研究共纳入99例(包括15例日本患者)经组织活检(LBx)或液体活检(TBx)确诊的MET外显子14跳跃突变的NSCLC患者。主要终点为独立评审委员会(IRC)评估的客观缓解率(ORR)。
结果显示:根据独立评审委员会评估,采用液体活检(LBx)或组织活检(TBx)检测证实为携带METex14跳跃改变的NSCLC患者中,tepotinib治疗NSCLC患者的客观缓解率(ORR)为42.4% ;在LBx、 TBx识别的患者中,中位缓解持续时间(DOR)为12.4个月(LBx识别的患者8.4个月;TBxi的患者9.7个月)。
VISION研究初步数据
此前FDA授予Tepotinib突破性药物资格,基于正在进行的VISION研究的数据,这些数据显示了初步的临床证据:
在液体活检或组织活检检测到73例MET基因存在第14号外显子跳跃突变转移性NSCLC患者中,不论患者之前接受过多少种疗法治疗,与当前可用疗法相比,tepotinib改善了患者的治疗结果。
(1)液体活检确定的患者中,独立审查委员会 VS 调查员评估的ORR为50.0% VS 55.3%;中位持续时间为12.4个月VS 17.1个月。
(2)组织活检确定的患者中,独立审查委员会 VS 调查员评估的ORR为45.1% VS 54.9%;中位持续时间为15.7个月VS 14.3个月。
不良反应
对130例患者的安全性分析中, tepotinib的耐受性良好。最常见的治疗相关不良反应有:周围水肿(53.8%)、恶心(23.8%)、腹泻(20.8%)。
未见4/5级不良反应,8.5%的患者因不良反应永久停药。
小结
tepotinib是默克公司发现的一种口服MET激酶抑制剂,可强效、高度选择性地抑制由MET基因改变(包括METex14跳跃改变、MET扩增、MET蛋白过度表达)引起的致癌信号,具有改善携带这些特定MET改变的侵袭性肿瘤患者治疗预后的潜力。
除了NSCLC之外,默克也正在积极评估tepotinib联合新疗法治疗其他肿瘤适应症。
【重要提示】本公号【全球好药资讯】所有文章信息仅供参考,具体治疗谨遵医嘱!



