DLL3/CD3双抗Tarlatamab治疗小细胞肺癌脑转移的真实世界疗效数据
2025年4月,国际著名肿瘤学期刊《胸部肿瘤学杂志》(Journal of Thoracic Oncology)近期发表了DLL3/CD3双特异性疗法Tarlatamab(塔拉妥单抗)治疗晚期小细胞肺癌(SCLC)脑转移患者的真实世界疗效数据。
小细胞肺癌(SCLC)患者的预后不佳,其中三分之二的患者在诊断时患有广泛期(ES)疾病,大约40%-70%的患者在病程中出现脑转移。虽然大多数ES-SCLC患者对一线治疗有反应,但疾病进展通常发生在6个月内。目前的二线治疗给予短时间的反应(DOR)和有限的生存期(OS)。
Tarlatamab(代号:AMG 757,商品名:Imdelltra,中文通用名:塔拉妥单抗)是一款靶向DLL3和CD3的潜在“first-in-class”双特异性T细胞衔接蛋白(BiTE)。作为一款BiTE,Tarlatamab可以将T细胞募集到小细胞肺癌细胞附近,激活T细胞杀伤肿瘤细胞。在I/II期研究中,Tarlatamab在既往接受过小细胞肺癌治疗的患者中表现出持久的抗癌活性和可控的安全性。
此前,2024年5月,Tarlatamab获美FDA加速批准,用于治疗广泛期小细胞肺癌(ES-SCLC)成人患者。他们在接受化疗时或之后出现疾病进展。值得一提的是,Tarlatamab是目前首个获批用于治疗侵袭性肺癌的DLL3靶向双特异性T细胞接合剂疗法。
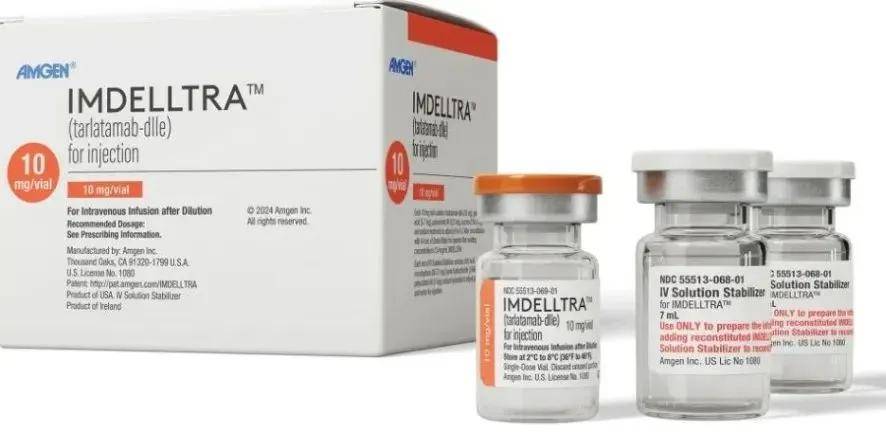
商品名:Imdelltra
通用名:塔拉妥单抗(Tarlatamab)
代号:AMG 757
靶点:DLL3、CD3
厂家:安进(Amgen)
美国首次获批:2024年5月
中国首次获批:尚未获批
规格:1mg、10mg
获批适应症:小细胞肺癌
推荐剂量:在第1周期第1天以1 mg分步给药剂量给予Tarlatamab 60分钟(±10分钟)静脉(IV)输注,然后在第1周期第8天和第1周期第15天给予10mg目标剂量。后续剂量(10 mg)将每2周给药一次(Q2W)(即第2周期及之后,第1天/第15天给药),28天为一个周期。用药时程:60分钟(±10分钟)。
储存条件:2℃至8℃冷藏
临床数据
已治疗且稳定的脑转移患者纳入了Tarlatamab的I期DeLLphi-300试验和II期DeLLphi-301试验。比如,在DeLLphi-300试验中,有16例患者的基线中枢神经系统病变≥10mm。结果显示,颅内疾病控制率为87.5%(14/16),平均持续时间为7.4个月。62.5%(10/16)的患者观察到中枢神经系统肿瘤缩小≥30%。然而,目前尚不清楚Tarlatamab在未经治疗、活动性或症状性脑转移的情况下是否安全有效。
在此次的病例系列中,首次报道了Tarlatamab治疗未经治疗的脑转移患者的安全性和有效性。在该队列中,有10例复发的小细胞肺癌和未经治疗的脑转移患者,包括有症状性颅内疾病者和一例怀疑有软脑膜疾病者,90%的患者有临床反应或病情稳定。此外,在具有多个脑转移瘤(>20病灶)患者中,观察到快速、显著的放射学反应和临床改善。这表明Tarlatamab可以作为单药治疗控制颅内转移,可能会减少或推迟对脑放疗的需要。
小结
总的来说,Tarlatamab在未经治疗、活动性或症状性脑转移的小细胞肺癌患者中,具有快速、显著的放射学反应和临床改善。
【重要提示】印塔健康旗下公众号【全球好药资讯】所有文章信息仅供参考,具体治疗谨遵医嘱!



